来源中国医疗频道
2022年2月28日,南京传奇/强生的CAR-T产品“西达基奥仑赛”获FDA批准上市!这是首款获美国FDA批准的,由中国药企设计和研发的CAR-T疗法;也是第二款由中国企业原创发明,获FDA批准的抗癌新药,距离上一款(百济神州泽布替尼)已经过去两年多。这是第二款获批上市的靶向BCMA的CAR-T疗法,也是中国第一款上市的靶向BCMA的CAR-T疗法。2017年底,该药物获得药品审评中心(CDE)批准开展临床,拉开了国内细胞药物研发的序幕。
国内首款获批上市的CAR-T药物是复星凯特的阿基仑赛注射液,于2021年6月23日正式获批。
2021年9月3日,药明巨诺的瑞基奥仑赛注射液也正式获批。这2款药物都是靶向CD19的CAR-T疗法,前者由Kite Pharma的Yescarta经过技术转移而进行本地化生产,后者则是建立在Liso-cel(JCAR017)基础上,由药明巨诺自主研发的一款CAR-T疗法,是我国首款1类生物制品的CAR-T产品。另外,2022年3月2日,瑞基奥仑赛注射液第2个适应证的上市申请获得CDE受理,有望年内获批。
那么,其他细胞药物目前的研发进度如何?离上市还有多远?下面为大家一一梳理。
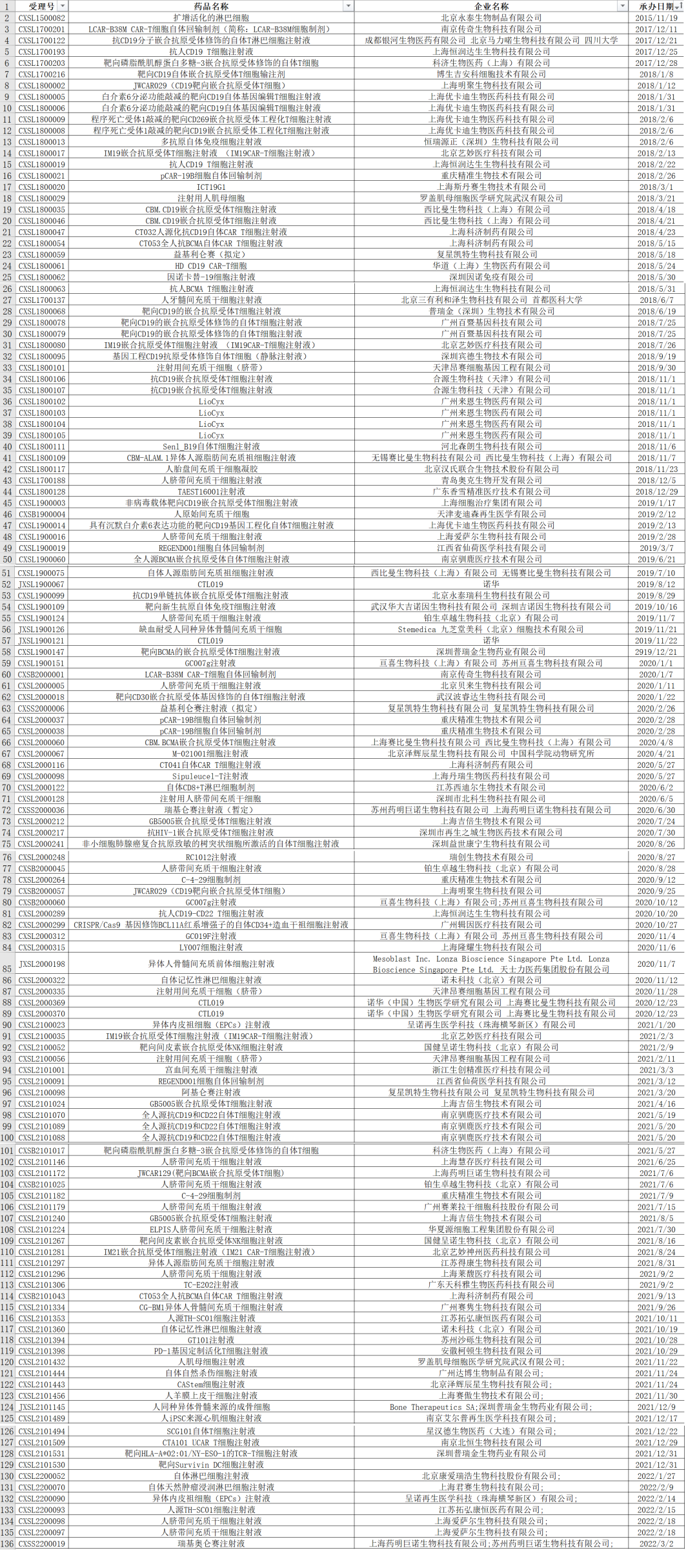
受理品种及获批情况
截至2022年3月9日,CDE共受理了135个细胞治疗产品的各类申请(自北京永泰扩增活化的淋巴细胞申请临床算起,该产品已获批临床,之前受理的标准较低,未纳入统计)。其中绝大部分为试验性新药(IND)申请(包括8项补充申请),仅有3个为上市申请(目前已获批2个)。在这135个申请中,70个为CAR-T,25个为其他类型的免疫细胞治疗;31个为MSC,其他类型的前体细胞为9个。
在132个临床申请中(包括近期受理、尚在审评中的品种),共有88个获批临床。
2022年2月28日,南京传奇/强生的CAR-T产品“西达基奥仑赛”获FDA批准上市!这是首款获美国FDA批准的,由中国药企设计和研发的CAR-T疗法;也是第二款由中国企业原创发明,获FDA批准的抗癌新药,距离上一款(百济神州泽布替尼)已经过去两年多。这是第二款获批上市的靶向BCMA的CAR-T疗法,也是中国第一款上市的靶向BCMA的CAR-T疗法。2017年底,该药物获得药品审评中心(CDE)批准开展临床,拉开了国内细胞药物研发的序幕。
国内首款获批上市的CAR-T药物是复星凯特的阿基仑赛注射液,于2021年6月23日正式获批。
2021年9月3日,药明巨诺的瑞基奥仑赛注射液也正式获批。这2款药物都是靶向CD19的CAR-T疗法,前者由Kite Pharma的Yescarta经过技术转移而进行本地化生产,后者则是建立在Liso-cel(JCAR017)基础上,由药明巨诺自主研发的一款CAR-T疗法,是我国首款1类生物制品的CAR-T产品。另外,2022年3月2日,瑞基奥仑赛注射液第2个适应证的上市申请获得CDE受理,有望年内获批。
那么,其他细胞药物目前的研发进度如何?离上市还有多远?下面为大家一一梳理。
受理品种及获批情况
截至2022年3月9日,CDE共受理了135个细胞治疗产品的各类申请(自北京永泰扩增活化的淋巴细胞申请临床算起,该产品已获批临床,之前受理的标准较低,未纳入统计)。其中绝大部分为试验性新药(IND)申请(包括8项补充申请),仅有3个为上市申请(目前已获批2个)。在这135个申请中,70个为CAR-T,25个为其他类型的免疫细胞治疗;31个为MSC,其他类型的前体细胞为9个。
在132个临床申请中(包括近期受理、尚在审评中的品种),共有88个获批临床。
1. CAR-T
在受理的70个CAR-T药物中,绝大部分为自体来源的CAR-T, 仅有2款异体来源的CAR-T药物[ 亘喜生物的GC007g注射液,包括2个受理号(CXSL1900151和CXSB2000060),已获批临床;南京北恒生物的CTA101 UCAR T细胞注射液,IND申请仍在审评中]。
靶点方面,大部分为CD19(包括亘喜生物的GC007g注射液),共47个;BCMA为11个;双靶点有6个;其余6个分别为GPC3(2个,CXSL1700203和CXSB2101017)、Claudin 18.2、CD20、CD30 和HIV-1(各1个)。
适应证方面, 除了科济生物的GPC3和Claudin18.2 CAR-T及重庆精准生物的C-4-29细胞制剂(双靶点,BCMA/CD70)为实体瘤外,其余均为血液系统肿瘤,涵盖FDA已获批的适应证(ALL、DCBCL、MCL、FL 和MM)。
值得注意的是,虽然诺华的CAR-T是全球首个获批的CAR-T药物,但布局中国市场较晚。诺华首选是自己递交临床申请,之后和西比曼旗下的上海赛比曼生物联合申报,已获批临床, 适应证为ALL和DCBCL,均已获得FDA批准。
2. 其他免疫细胞
25个CAR-T之外的免疫细胞中,包括多种类型,共有9个获批临床,具体如下。
(1) 广东香雪的TAEST16001注射液,为TCR-T,适应证为软组织肉瘤;
(2)三胞集团旗下的上海丹瑞引进的Sipuleucel-T注射液,为树突状细胞,FDA已获批上市, 适应证为前列腺癌;
(3)武汉华大吉诺因的靶向新生抗原自体免疫T细胞注射液,为T 细胞,适应证为实体瘤;
(4) 瑞创生物的RC1012注射液,为双阴性T细胞,适应证为AML;
(5)北京永泰的扩增活化的淋巴细胞,适应证为肝癌;
(6)国健呈诺的靶向间皮素嵌合抗原受体NK细胞注射液,适应症位为晚期上皮性卵巢癌;
(7)广东天科雅生物的TC-E202注射液,适应症为HPV16阳性既往治疗失败的复发或者转移性宫颈癌;
(8)诺未科技的自体记忆性淋巴细胞注射液,适应症为原发性肝细胞癌根治术后高复发风险患者;
(9)广州达博生物的自体自然杀伤细胞注射液,适应症为消化道肿瘤。
3.MSC
MSC共有25个受理(包括同一产品不同适应证)获批临床;MSC的来源包括胎盘、脐带、骨髓、脂肪和宫血。适应证包括GVHD、膝骨关节炎及其他13种适应证。其中,西比曼的自体人源脂肪间充质祖细胞注射液是唯一自体来源的MSC,其余均为异体。Stemedica和九芝堂美科联合申报的缺血耐受人同种异体骨髓间充质干细胞,注册分类为进口,其余均为国产。
4. 其他前体细胞
共有3个受理获批临床,包括江西省仙荷(吉美瑞生旗下)的REGEND001细胞自体回输制剂(肺基底层细胞,适应证分别为肺弥散功能障碍的慢性阻塞性肺疾病和特发性肺纤维化)和广州辑因的CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液。
